Как я вылечил глиому головного мозга
Лечение глиом головного мозга и ее прогноз
Для того чтобы определить гистологический тип опухоли и в ряде случаев выбрать подходящий метод лечения больного, желательно провести биопсию или удалить опухоль.
Однако радикальное удаление опухоли может привести к опасным последствиям, и для взятия образца, в случае неоперабельной опухоли, используется методика стереотактической биопсии, проводящейся под контролем КТ.
При развитии гидроцефалии операция вентрикулоперитонеального шунтирования заметно улучшает состояние больного. При глубоком расположении опухоли (зрительный бугор, шишковидное тело и ствол мозга) не рекомендуется проводить даже биопсию.
В некоторых случаях необходимо быстро купировать острый отек мозга. Для этого больному вводят внутривенно мочевину, маннит или назначают большую дозу дексаметазона.Часто у детей и взрослых, наряду с хирургией, в качестве адъювантного метода использую лучевую терапию. Хотя химиотерапевтические препараты применяют все чаще, вопросы эффективности лекарственного лечения остаются дискуссионными.
Лечение низкозлокачественных (степень I и II по классификации Керногана) глиом головного мозга
Эти опухоли обычно пытаются удалить хирургическим путем, поскольку они имеют локализованный характер, и окружающие структуры при резекции повреждаются незначительно. Поэтому во многих случаях хирургия остается единственным методом их лечения. Однако, для более злокачественных опухолей особенно, могут наблюдаться рецидивы.
При неполном удалении опухоли, по крайней мере взрослым больным, в настоящее время назначают лучевую терапию. Исследование в клинике Майо 167 больных с низкозлокачественной астроцитомой показало, что для группы с пилоцитарной опухолью (41 человек) независимо от послеоперационного лечения отмечался благоприятный прогноз.
У остальных больных лучевая терапия привела к увеличению выживаемости, особенно если доза на опухоль превышала 53 Гр. В этом случае 5-летняя выживаемость составила 68%, по сравнению с 21% в группе, не получавшей лучевой терапии. Интересно, что полнота удаления опухоли, по-видимому, не играет критической роли, и таким образом основным методом лечения низкозлокачественных глиом является лучевая терапия. К опухолям, развивающимся у детей, вероятно, применимы те же общие принципы лечения.
Хотя сейчас все чаще рекомендуют использовать лучевую терапию во всех случаях после операции, крупномасштабное исследование, проведенное несколькими европейскими клиниками, не показало достоверного увеличения лечебного эффекта у оперированных больных с низкозлокачественными глиомами мозга после лучевой терапии.
В группе из 379 отобранных больных часть облучали в дозе 45 Гр на протяжении 5 недель, а часть в дозе 59,4 Гр на протяжении 6,6 недели. Медиана времени наблюдения составляла 74 месяца. При этом как общая выживаемость, так и выживаемость без прогрессирования заболевания в обеих группах была почти одинаковой (58% и 48% соответственно).

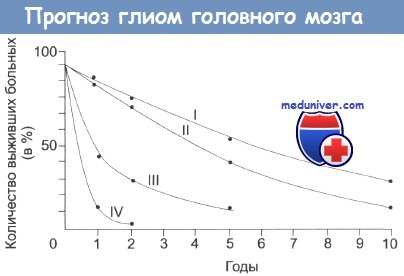
Продолжительность жизни больных со злокачественной глиомой различной степени.
Отметьте, что даже в случаях низкозлокачественной опухоли выживает немного больных.
Лечение высокозлокачественных (степень III и IV по классификации Керногана) глиом головного мозга
В случаях этих опухолей почти всегда после операции проводят лучевую терапию. Во-первых, при хирургической операции редко удается полностью удалить опухоль, и, во-вторых, одна операция дает неудовлетворительные результаты. Последние данные показывают, что после проведения операции по поводу мультиформной глиобластомы больные не живут дольше года.
Однако пятая часть больных, получивших лучевую терапию, после операции жили по крайне мере в течение года. Необходимо облучать большой объем ткани, иногда весь мозг. Часто используют дозу 40-50 Гр, назначаемую в режиме фракционирования в течение 4,5-6 недель, или более высокие дозы, если опухоль локализована. Однако окончательный прогноз остается крайне неблагоприятным, и 5-летняя выживаемость больных с опухолью IV степени составляет менее 6%. Для больных с опухолью III степени выживаемость выше, и почти половина больных возвращается к нормальной жизни.
Попытки улучшить эти печальные цифры привели к использованию широких полей облучения или к назначению более высокой дозы, поскольку причиной смерти больных почти всегда является локальный рецидив опухоли. Если бы можно было найти безопасный способ увеличить дозу, то можно было более эффективно контролировать локальный рост опухоли.
Поэтому большой интерес вызывают три новых метода облучения: интерстициальная брахитерапия, стереотактическое облучение внешним пучком и гиперфракционирование дозы.
Интерстициальная брахитерапия с применением изотопов 125Ir или 60Со позволяет облучить определенный объем ткани опухоли в высокой дозе, не затрагивая при этом больших участков здоровой ткани, и метод может быть использован совместно со стереотактической хирургией. Большая серия исследований из Сан-Франциско дает основание предполагать, что этот метод может оказаться перспективным как для лечения первичных опухолей, особенно опухолей III степени, так и их локальных рецидивов.
Однако блестящие результаты, полученные при этом исследовании, могут объясняться тщательным отбором больных с опухолями определенной величины, а также по критерию общего состояния. Действительно, эти факторы, наряду с возрастом больных и их анамнезом, имеют важное прогностическое значение. К сожалению, использование брахитерапии для облучения опухоли в больших дозах не предотвращало у больных нарушений локорегионального характера.
В последнее время стали широко применять стереотактическую радиохирургию с использованием внешнего пучка. По сравнению с интерстициальным облучением, этот метод обладает рядом преимуществ. Он не является инвазивным и может быть использован совместно с традиционной лучевой терапией (облучение внешним пучком в широком поле), даже при облучении всей области мозга.
Для радиохирургии подходит лишь ограниченный контингент больных, однако этот метод перспективен при лечении небольших хорошо локализованных опухолей, размеры которых не позволяют провести резекцию. К числу таких опухолей относятся новообразования ствола мозга, зрительного бугра и зрительного тракта. Степень точности, которая достигается при стереотактической радиохирургии, позволяет надеяться, что можно облучить ограниченный объем ткани в более высокой дозе, чем это позволяют сделать другие методы с использованием внешнего пучка.
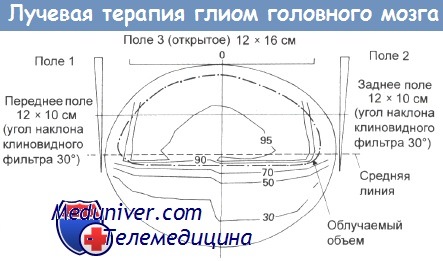
Облучение глиомы коры мозга внешним пучком.
Трехпольное облучение всего полушария мозга. Облучаемый объем показан пунктирной линией.
Иногда при лечении хирургическим методом и лучевой терапией больных с высокозлокачественными глиомами в качестве адъювантных средств используют цитотоксические препараты. Наиболее часто применяют нитрозомочевины: бис-хлорэтилнитрозомочевину (БХНМ) и цис-хлорэтилнитрозомочевину (ЦХНМ), поскольку эти препараты растворимы в липидах и проходят через гематоэнцефалический барьер.
Оценить реакцию опухоли мозга на цитотоксические препараты сложно, но несомненно, что состояние некоторых больных с рецидивами опухоли улучшается, хотя в большинстве случаев препараты оказывают лишь кратковременный эффект. В обширном проспективном исследовании Уокера с сотрудниками показано, что назначение больным БХНМ после проведения операции и лучевой терапии продлевает медиану выживаемости всего на несколько недель.
Лечение хирургическим способом с последующим назначением химиотерапевтических препаратов (без лучевой терапии) оказалось гораздо менее эффективным. Возможно, что ЦХНМ несколько более эффективен, чем БХНМ.
Недавно в клиническую практику поступил темозоломид — новый цитотоксический препарат, эффективный по отношению к глиомам. Он представляет собой алкилирующий агент и является производным мутозоломида. В отличие от последнего темозоломид в меньшей степени подавяет миелопоэз. При лечении рецидивов глиобластомы препарат оказался более эффективным, чем прокарбазин. В настоящее время исследуется возможность применения темозоломида при первичном лечении мультиформной глиобластомы, и похоже, что препарат представляет собой перспективное средство.
Несмотря на большое количество мелкомасштабных рандомизированных исследований, проведенных за 30 минувших лет, роль химиотерапии в лечении больных с высокозлокачественными глиомами пока нельзя считать выясненной. Данные последнего мета-анализа продемонстрировали 6% увеличение 2-летней выживаемости больных, получавших лекарственное лечение. Несомненно, что этот результат будет стимулировать дальнейшие исследования возможности применения лекарственных средств для лечения опухолей мозга. Внутриартериальное введение препаратов оказалось неприемлемым из-за появления сильных токсических эффектов.
К числу прочих цитостатических препаратов относятся винкристин и прокарбазин. По сравнению с другими средствами, они обладают относительно меньшей токсичностью. Некоторой противоопухолевой активностью также обладают цисплатин и вепезид (VM26).
Одна из наиболее часто используемых рецептур содержит прокарбазин, ЦХНМ и винкристин (PCV). Она хорошо переносится больными и обычно назначается амбулаторно в качестве адъювантного средства на протяжении 6-недельного срока
Лечение олигодендроглиом головного мозга
Олигодендроглиомы часто хорошо дифференцированы, отличаются медленным ростом и могут быть полностью удалены хирургическим путем. При подозрениях на неполноту удаления или при агрессивной опухоли (иногда называемой олигодендробластома) рекомендуется проводить лучевую терапию.
По данным Шелина с сотрудниками, полученным на группе больных, состоящей более чем из 30 человек, 5-летняя выживаемость после хирургического лечения составляла 31%, а среди больных, получивших после операции курс лучевой терапии, 85%. Основываясь на этих и других данных, можно заключить, что 10-летняя выживаемость больных составляет порядка 35%.
Накапливаются данные о чувствительности олигодендроглиомы к химиотерапевтическим препаратам, таким как PCV и цисплатин.
Лечение глубоколокализованных глиом головного мозга
Глиомы, расположенные в глубинных структурах коры головного мозга, создают серьезные трудности для диагностики и лечения. К числу таких структур относятся зрительный бугор и гипоталамус, варолиев мост, ствол мозга, шишковидное тело и глазной нерв. Из-за опасности хирургического вмешательства гистологическое подтверждение диагноза часто оказывается невозможным. Однако растет число онкологов, считающих, что в случае глиомы шишковидного тела целесообразно отобрать образец ткани из пинеальной области, поскольку гистологические характеристики опухоли являются основным фактором, определяющим метод лечения.
Клинически эти опухоли проявляются по-разному. При глиоме глазного нерва обычно развивается проптоз или слепота, и онкологи часто считают, что имеют дело с доброкачественной опухолью, устойчивой к лучевой терапии. В некоторых случаях, однако, возникает билатеральная опухоль, поражающая перекрест зрительных нервов, или распространяющаяся на желудочки; при этом иногда развивается гидроцефалия. Больным с такими опухолями назначают лучевую терапию.
Хотя при отсутствии клинических признаков развития опухоли проведение терапевтических мероприятий может не понадобиться, лучевая терапия облегчает состояние больных с тяжелым проптозом, что объективно подтверждается результатами КТ и магнитно-резонансных исследований. Пирс с соавторами сообщают о результатах продолжительного наблюдения над группой, состоящей из 24 детей с глиомой глазного нерва (медиана времени составляла 6 лет). Общая 6-летняя выживаемость детей составила 100%, и более чем у 90% наблюдалось улучшение («стабилизация») зрения.
При развитии опухоли зрительного бугра почти единственным средством лечения является лучевая терапия, поскольку операция или даже попытка взятия пробы ткани чрезвычайно опасны. Прогноз зависит от возраста больного, хотя, как и следует ожидать, важным фактором является гистологическая характеристика опухоли. При этом гистологический анализ проводили на аутопсийном материале. У пациентов молодого возраста с глиомой III степени 5-летняя выживаемость составляет около 25%.
Опухоли варолиева моста и ствола мозга отличаются крайне неблагоприятным прогнозом. Обычно у больных проявляются флоридные симптомы, включающие паралич черепных нервов, атаксию или поражение длинных трактов. Обычно опухоль представляет собой высокозлокачественную инфильтрирующую астроцитому, которая к моменту постановки диагноза достигает большого размера. Часто больные нуждаются в срочном лечении, однако, поскольку опухоли иноперабельны, единственным средством остается лучевая терапия.
В большинстве случаев она дает симптоматические результаты, однако выживаемость больных остается на низком уровне (около 15%). По данным наблюдения за больными с опухолями ствола мозга, леченными лучевой терапией, они в среднем живут 4 года, в то время как больные, не проходившие курса, всего 15 месяцев. Если эффективность лучевой терапии подтверждается объективными методами, то средняя продолжительность жизни больных превышает 5 лет. Поскольку опухоль обычно распространяется на варолиев мост, ствол и кору мозга, а часто на верхнюю часть шейного отдела позвоночника, облучение проводят с двумя большими латеральными полями по обеим сторонам черепа.
Обычно назначают дозы порядка 40-55 Гр в течение 4—5 недель при ежедневном режиме облучения. В некоторых клиниках облучают более крупными фракциями, например в режиме фракционирования дозы 45-48 Гр в течение 15 дней.
– Также рекомендуем “Лечение эпендимомы головного мозга и ее прогноз”
Оглавление темы “Опухоли головного мозга”:
- Частота опухолей головного мозга – эпидемиология
- Механизмы развития опухолей головного мозга
- Классификация опухолей головного мозга
- Глиомы головного мозга – варианты, прогноз
- Опухоли гипофиза – варианты, прогноз
- Менингиома – варианты, прогноз
- Редкие опухоли головного мозга: пинеальные опухоли, лимфомы, хордомы
- Клиника опухоли головного мозга и ее диагностика
- Лечение глиом головного мозга и ее прогноз
- Лечение эпендимомы головного мозга и ее прогноз
Источник
Добрый вечер, данный диагноз мне поставлен в апреле 14 года. И первое, что хотелось бы написать, не опускайте руки, все случаи индивидуальны. Моя история началась с головных болей на пике которых меня рвало, но уточню головная боль меня преследовала с детства. Особенно это начало проявляться при езде за рулём, после вождения голова начинала болеть 100%. Ну соответственно поход к терапевту, направление на МРТ, шок, но не паника, метания куда обратится. Через знакомых попал на консультацию в Бурденко, назначили стандартно: химия, операция, химия + облучение. Наверно это самое сложный период, все как снег на голову: квоты, зачем то или иное, куда идти, что за лекарство, спросить не у кого это все, ожидание операции. Вот тут очень нужна помощь и поддержка близких, особенно жены ну или мужа. И вот еще, что: не надо копаться в интернете с заголовком “глиобластома прогнозы”… ничего хорошего там нет, оно вам и не надо, как я сказал все индивидуально, как вы для себя решите…поникнуть и уйти в себя или бороться. Я для себя, решил бороться.
Перед операцией, сходите на службу, исповедуйтесь, у меня была генеральная исповедь в храме Николая Чудотворца при Бурденко. Под конец исповеди я ревел, грехов за мной было много. Причастившись, отлегло как то, не было страха того уже. Утром и вечером, молитвы отче наш и символ веры, когда увозили на операцию, без конца повторял Иисусову молитву пока не ушёл в темноту. Очнувшись в реанимации, я чувствовал себя…сложно описать то чувство радости, кто то кричал, что болит голова, кого то тошнило, меня распирало от благодати, я лежал и восхвалял господа. Потом скушал кашу, выпил какао, скушал еще добавку каши. Приходили врачи, просили шевелить руками и ногами. Перевезли в палату, долежал положенное и выписка. Первое время пролеживая бока дома и ездя на облучение, ушел в чтение разной литературы по проблеме. Как отошел от операции начал бегать, каждый день, через день, закаливаться постепенно, ездил по святым источникам с друзьями и родными, к мощам святых и т д. Отказался от красного мяса, макарон, сдобных булок, белого риса и т.п., самое главное от сахара, т.к. глюкоза топливо для раковых клеток. Побольше фруктов, ягод, воды ( я пью Светла, почитайте о ней), держите себя в хорошем настроении, больше позитивных эмоций, цепляйтесь за будущее, верьте…живите не ради чего то, а ради самой жизни, радуйтесь каждому дню. Человеку не обременённому данной проблемой, жизнь как данность, зря. Включите в свой рацион горькие косточки абрикосов или яблочных, в них содержится витамин Б17 (амигдалин или лаэтрил) вкратце это 2 атома яда (цианид и бензальдегид и 1 атом глюкозы скрепляющий их, как только раковая клетка поглощает глюкозу, 2 этих яда выходят наружу и уничтожают раковые клетки (прочтите книгу Эдварда Гриффина “Мир без рака”).
Для хороший переносимости химии, детоксикации организма я пил отвар из трав (флорэссенс, эссиак), прочтите книгу “целебная формула мадам Кайс”, так же в рационе был творог с льняным маслом почитайте про метод Джоанны Бадвиг. Ну и параллельно я принимал ДЦА, прочтите в интернете. Как то так выглядит мой протокол, чувствую себя прекрасно, чего и вам желаю.
П.С. Все это я делал и принимал с верой в божью милость.
Из фактов: Мои волосы после облучения выросли через несколько месяцев, а не как говорили от года.
Все мои анализы стали лучше чем до операции.
Я сбросил 11 кг, с 89 до 78.
Здоровья вам!
Источник
Нейроэндоскопия означает, что нейрохирург может делать операции на головном мозге через очень маленькое отверстие в черепе. Хирург может видеть то, что находится на кончике эндоскопа либо через окуляр микроскопа или на экране телевизора. Крошечные щипцы и ножницы на конце эндоскопа могут быть использованы, чтобы срезать опухоль или взять биопсию. Этот тип операции особенно эффективен для удаления опухолей в заполненных жидкостью пространствах (желудочках) мозга. Такой вариант возможен также с использованием робота – манипулятора да-Винчи – он значительно облегчает проведение операции, но почти вдвое дороже.
Нейрохирург может предложить операцию по удалению опухоли мозга под местной анестезией, если у пациента опухоль близко к той части мозга, которая управляет сознательный функцией – зона Брока. Опасность проведения операции на этой зоне мозга – это вероятность повреждения двигательной, глотательной, речевой функции. Поэтому в процессе операции под местной анастезией врач или мед. сестра будут оставаться на связи с пациентом, разговаривая с ним и проверяя его реакцию. Следует отметить, что в головном мозге нет нервных окончаний, поэтому все вмешательства не доставляют пациенту боли.
После удаления глиобластомы в область опухоли врач может установить новое лекарство – имплантируемые пластины Глиадел — GLIADEL® Wafer (полифепросан 20 с кармустином, имплантат) . Оно применяется в качестве высокодозной химиотерапии локального действия — данный препарат один из наиболее эффективных методов локальной химии, который минимизирует возможность возникновения рецидива рака в будущем.
Лучевая терапия обычно следует за операцией. Радиация убивает опухолевые клетки, которые могут остаться в этом районе. При единичных метастазах в головной мозг Израильские врачи могут порекомендовать радиотерапию на новом оборудовании – линейном ускорители Новалис (Novalis®). Вместо продолжительных курсов лучевой терапии новая технология позволяет за 1-2 сеанса достичь значительных улучшений в лечении рака мозга. Новейший ускоритель “Новалис”, представляет собой совершенно новый подход лечения, позволяющий проведение радиохирургии без необходимости фиксации жёсткой рамы на голове. Данный метод причиняет меньше неудобств и значительно легче переносится пациентами. Данный линейный ускоритель, разработанный компанией BrainLab, позволяет достигнуть максимально правильного положения пациента, что обесопечивает проведение облучения с точностью наведения до 0.5 мм. Он позволяет высококвалифицированным нейрохирургам и радиотерапевтам проводить процедуры, которые до настоящего времени характеризовались повышенным риском осложнений. Нередко проведение такого лечения отменяет необходимость в сложном хирургическом вмешательстве.
Стереотаксическая радиохирургия может рассматриваться в качестве отдельного лечения или в качестве дополнительного лечения после операции в случаях, когда полное удаление опухоли не представляется возможным. На выбор метода лечения влияет множество факторов, например — тип опухоли.
В 2005 году препарат Темозоломид (Temodal) был одобрен для лечения впервые выявленных больных с глиобластомой GBM. Рандомизированная фаза клинического исследования показала, что он добавил 2,5 месяца к медиане выживаемости пациентов. Тем не менее, более 50% опухолей генерируют репарации ДНК белка, называемый MGMT (метилгуанин метилтрансферазы), который эффективно нейтрализует темозоломид химиотерапию. Эти пациенты получают незначительную терапевтическую пользу от темозоломида и их лечение химиопрепаратом неэффективно.
DCVax®-Brain – персонализированная дендритноклеточная вакцина для лечения Glioblastoma multiforme, проходит II фазу одобренных FDA клинических испытаний. Созданная вакцина стимулирует иммунную систему человека, учит ее распознавать, атаковать и уничтожать раковые клетки, как это и должно происходить.
Хирурги операционным путем удаляют как можно большой объем опухоли; далее резецированная опухоль используется, чтобы создать индивидуальную вакцину, рассчитанную на иммунную систему носителя. Пациенты все еще проходят лучевую и радиотерапию, но вакцина уже в состоянии позволить организму бороться с опухолью самостоятельно. Исследования показали, что DCVax позволяет задерживать развитие повторной опухоли мозга и обеспечивает пациентам высокое качество жизни. Ученые уже использовали в отношении лекарственного средства эпитет “многообещающее”, что для больных означает возможность пройти курс лечения, не дожидаясь окончания длительного процесса официальной регистрации препарата.
Ученые изучают эффективность антител, получаемых в лаборатории, которые называются моноклональные антитела (МАТ). Эти антитела вырабатываются одним типом клеток, они специфичны для определенного антигена. Ученые рассматривают способы создания моноклональные антитела, специфичных для антигенов, которые обнаружены на поверхности различных раковых клеток.
Чтобы создать моноклональные антитела, ученые сначала вводят мышам человеческие раковые клетки. В ответ иммунная система мышей вырабатывает антитела. Затем ученые забирают плазмоциты мышей, которые вырабатывают антитела, и соединяют их с клетками, выращенными в лаборатории, создавая гибридные клетки, которые называются гибридомы. Гибридомы постоянно образуют большое количество этих чистых антител, или МАТ. МАТ можно использовать для лечения рака разными способами.
К сожалению, не смотря на все принимаемые меры, глиобластома возвращается, но нельзя опускать руки – каждый год разрабатывают новые методики и новые препараты, помогающие сохранить полноценную жизнь на длительное время.
Источник
