Как вылечить миопатию беккера

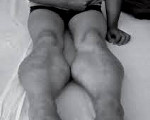
Прогрессирующая мышечная дистрофия Беккера — вариант наследственной сцепленной с Х-хромосомой миодистрофии, отличающейся более замедленным и доброкачественным течением. Заболевание характеризуется постепенно усугубляющейся и распространяющейся мышечной слабостью, гипотонией и атрофией, первоначально возникающей в мышцах бедер и тазового пояса. Диагностический поиск включает неврологическое обследование, консультацию генетика и кардиолога, нейрофизиологическое тестирование нервно-мышечного аппарата, ДНК диагностику, биопсию мышц с морфологическим, иммунологическим и гистохимическим изучением полученных образцов. Лечение симптоматическое и, к сожалению, малоэффективное. Прогрессирование болезни приводит к потери больными способности самостоятельно передвигаться к возрасту 40 лет.
Общие сведения
Прогрессирующая мышечная дистрофия Беккера впервые была описана в 1955 г. как доброкачественный вариант течения мышечной дистрофии Дюшенна. В последующем многочисленные исследования в области клинической неврологии, генетики и биохимии обнаружили существенные отличия в характере течения, биохимической и морфологической основе этих заболеваний. В результате клиническая форма Беккера была выделена как самостоятельная нозология.
Мышечная дистрофия Беккера входит в группу миопатий (миодистрофий) — заболеваний, возникающих вследствие нарушений строения и метаболизма мышечной ткани и проявляющихся мышечной слабостью. Патология наследуется рецессивно сцеплено с Х-хромосомой, поэтому болеют только лица мужского пола. Частота встречаемости составляет 1 новорожденный на 20 тыс. детей.
Прогрессирующая мышечная дистрофия Беккера
Причины возникновения
В основе заболевания лежит мутация в гене, ответственном за кодирование белка дистрофина. Примерно 30% от общего числа случаев мышечной дистрофии Беккера приходится на т. н. «свежие» мутации. Ген располагается в 21 локусе (в регионе Хр21.2–р21.1) короткого плеча Х-хромосомы. Примерно у 65-70% больных обнаруживаются крупные делеции указанного участка, у 5% – дупликации, у остальных — точковые мутации. Указанные структурные перестройки гена не влекут за собой полного прекращения синтеза дистрофина, как при дистрофии Дюшенна, а потенцируют синтез аномального усеченного белка, в некоторой степени способного выполнять свои функции. Это и обуславливает более доброкачественный характер дистрофии Беккера в сравнении с вариантом Дюшенна.
В норме белок дистрофин поддерживает целостность сарколеммы – мембраны миоцитов (мышечных волокон), обеспечивает эластичность и устойчивость миофибрилл при мышечном сокращении. Неспособность аномального дистрофина адекватно выполнять эти функции приводит к нарушению целостности мембран мышечных волокон. В следствие этого происходят дегенеративные изменения цитоплазматических компонентов последних и повышенная транспортировка ионов калия внутрь миоцитов. Результатом таких биохимических и морфологических сдвигов является гибель миофибрилл и разрушение мышечных волокон. На месте погибших миоцитов происходит образование соединительной ткани, что обуславливает феномен псевдогипертрофии — увеличение объема и плотности мышцы при резком снижении ее сократительной способности.
Симптомы
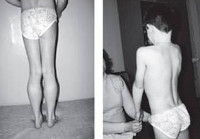
Прогрессирующая мышечная дистрофия Беккера манифестирует обычно в период от 10 до 15 лет, в некоторых случаях раньше. Начальными признаками заболевания выступают чрезмерная утомляемость и мышечная слабость в тазовом поясе и нижних конечностях. У ряда пациентов первыми проявлениями являются периодические болезненные мышечные судороги (крампи), локализующиеся в ногах. Мышечная слабость обуславливает затруднение при подъеме по лестнице, при необходимости встать из положения сидя. Со временем формируется переваливающаяся «утиная» походка. Для того, чтобы встать, пациент вынужден использовать вспомогательные миопатические приемы — опираться руками о расположенные рядом предметы мебели или, при отсутствии таковых, использовать в качестве опоры собственное тело (симптом Говерса).
Как и другие наследственные миопатии, заболевание Беккера характеризуется симметрично развивающимися атрофиями мышц. В первую очередь поражаются мышцы бедра и тазового пояса, затем процесс распространяется на мускулатуру плечевого пояса и проксимальных мышц рук. В начале болезни формируются псевдогипертрофии, наиболее выраженные в икроножных, дельтовидных, трех- и четырехглавых мышцах. По мере прогрессирования миодистрофии они трансформируются в мышечные гипотрофии.
Клиническая картина мышечной дистрофии Беккера во многом сходна с миодистрофией Дюшенна. Усугубление мышечной слабости с течением времени приводит к обездвиженности пациента и формированию контрактур суставов. Однако развитие дистрофического процесса в мышечной ткани при дистрофии Беккера идет гораздо медленнее, что обуславливает длительную двигательную активность больных. В среднем пациенты сохраняют способность самостоятельно передвигаться до 35-40-летнего возраста. Кроме того, дистрофия Беккера не сопровождается олигофренией, выраженным искривлением позвоночника и другими скелетными деформациями. Возможна кардиомиопатия дилятационного или гипертрофического типа, блокада ножек пучка Гисса, но сердечно-сосудистые расстройства выражены умеренно. Может наблюдаться снижение либидо, гинекомастия, атрофия яичек, импотенция.
Диагностика
Прогрессирующая мышечная дистрофия Беккера диагностируется неврологом на основании анамнеза, клинических данных, дополнительных обследований и генетического тестирования. В неврологическом статусе наблюдается снижение мышечной силы и умеренное снижение мышечного тонуса в проксимальных отделах конечностей, выпадение коленных рефлексов при симметричном снижении сухожильных рефлексов дистальных отделов ног и верхних конечностей, полная сохранность чувствительности.
Среди клинических анализов наибольшее значение имеет биохимический анализ крови, который выявляет многократное повышение уровня КФК. Данные электронейрографии позволяют исключить поражение нервных волокон, электромиография свидетельствует о первично-мышечном типе поражения. Биопсия мышц проводится только после отрицательных результатов генетического анализа. Морфологическое исследование полученного материала определяет диффузную разнокалиберность, дистрофические и некротические изменения мышечных волокон, разрастание соединительной ткани. Проводится специальное иммунное окрашивание образцов с последующим определением наличия в них дистрофина.
Подтвердить диагноз мышечной дистрофии Беккера позволяет консультация генетика с проведением анализа ДНК. Выявление дупликаций или делеций в гене Хр21 дает возможность установить точный диагноз. Отрицательный результат анализа ДНК не говорит об отсутствии патологии, поскольку могут иметь место точковые мутации, поиск которых представляет собой сложную и более дорогостоящую процедуру.
С целью выявления сердечной патологии назначается электрокардиография, Эхо-КГ, консультация кардиолога. Кардиологическое обследование может обнаружить нарушение внутрижелудочковой проводимости, АВ-блокаду, дилатацию желудочков, гипертрофические изменения миокарда, кардиомиопатию, сердечную недостаточность.
Дифференциальная диагностика проводится с прогрессирующей мышечной дистрофией Дрейфуса, миодистрофией Дюшена, мышечной дистрофией Эрба-Рота, метаболической миопатией, полимиозитом и дерматомиозитом, воспалительной миопатией, спинальной амиотрофией, наследственной полиневропатией.
Пренатальная диагностика рекомендована, когда мать является носителем патогенного гена. Если ребенок мужского пола, то вероятность развития заболевания у него составляет 50%. Биопсия хориона может проводиться в сроке 11-14 нед. беременности, амниоцентез — после 15-й недели, забор пуповинной крови (кордоцентез) — на сроке больше 18 нед.
Лечение
На современном этапе несколькими группами ученых ведутся настойчивые исследования в области поиска эффективных методов лечения прогрессирующих миодистрофий. В настоящее время пациенты получают в основном метаболическую и симптоматическую терапию. Разработаны различные схемы лечения, позволяющие улучшить двигательные возможности больного и несколько замедлить прогрессирование болезни. Пациентам назначают актопротекторы (этилтиобензимидазол), неостигмин, АТФ, анаболические стероиды (метиландростендиол), сердечные средства. По вопросу длительной терапии глюкокортикоидами (преднизолоном) клиницисты имеют различные мнения. Одни считают, что подобное лечение тормозит прогрессирование миодистрофии, другие отвергают это предположение.
Наблюдения показали, что постельный режим усугубляет мышечную слабость. Поэтому пациентам рекомендуется умеренная физическая активность, занятия плаваньем. Поддержание мышечной эластичности и силы, а также профилактика контрактур проводится средствами массажа, физиотерапии и лечебной гимнастики. По показаниям проводится хирургическое лечение контрактур. Применение различных ортопедических средств (ходунков, инвалидных колясок, фиксаторов для ног, экзоскелетов) позволяет расширить двигательные возможности пациентов и их способность к самообслуживанию. По показаниям проводится хирургическое лечение контрактур.
Прогноз и профилактика
Прогрессирующая мышечная дистрофия Беккера имеет неблагоприятный прогноз. Хотя обездвиженность у пациентов наступает гораздо позже, чем при дистрофии Дюшенна, в конечном итоге поражение сердечной мышцы и дыхательной мускулатуры приводят к гибели пациентов от сердечной или дыхательной недостаточности. Продуманный уход, адекватная терапия, вентиляционная поддержка дыхания, применение ортопедических средств могут лишь увеличить продолжительность и улучшить качество жизни пациента. Профилактика заключается в предупреждении рождения ребенка с патологией путем генетического консультирования будущих родителей и проведение пренатальной диагностики.
Источник
Миотония Беккера — патология с аутосомно-рецессивным типом наследования, обусловленная гипервозбудимостью мышечных волокон скелетной мускулатуры и проявляющаяся нарушением расслабления мышц после их сокращения. Клиническая картина заболевания складывается из миотонического симптомокомплекса, проявляющегося вначале в нижних, а затем и в верхних конечностях. Установить диагноз помогает тщательное исследование анамнеза, данные неврологического осмотра, ЭМГ и биопсии мышц, генетическое консультирование. Лечение основано на применении медикаментов, уменьшающих миотонические спазмы, диуретиков и препаратов кальция. Пациентам показана физиотерапия и ЛФК.
Общие сведения
Первое медицинское описание врожденной миотонии относится к 1876 году. Оно было сделано датчанином Юлиусом Томсеном. Длительное время миотония Томсена считалась единственным вариантом данного заболевания. Однако в 1971 году немцем Эмилем Питером Беккером была описана более тяжелая форма врожденной миотонии, имеющая иной порядок наследования. В современной неврологии она известна как миотония Беккера.
Оба заболевания представляют собой аллельные варианты мутаций гена CLCN1, локализующегося на длинном плече 7-й хромосомы. Совместная частота их встречаемости в Европе составляет примерно 1 случай на 100 тыс. семей, а в Скандинавии — 1 случай на 10 тыс. семей.
Миотония Беккера
Этиология и патогенез миотонии Беккера
Причина развития болезни Беккера кроется в передаваемом по наследству дефекте гена CLCN1, кодирующего белок хлорных каналов мышечных волокон скелетных мышц. При функциональной неполноценности белка или его отсутствии снижается способность хлорных каналов пропускать ионы хлора внутрь мышечного волокна. Вследствие этого нарушается ионное равновесие и возникает электрическая нестабильность мембраны волокна, что приводит к гипервозбудимости последнего. В результате в ответ на обычные нервные импульсы происходит повышенное возбуждение мышечных волокон, клинически проявляющееся замедленным расслаблением мышц после их сокращения.
Заболевание наследуется аутосомно-рецессивно, т. е. его развитие у ребенка происходит только в тех случаях, когда оба родителя являются носителями патологического гена.
Симптомы миотонии Беккера
В отличие от болезни Томсена, проявление первых симптомов которой неонатологи наблюдают сразу же после рождения или в периоде новорожденности, миотония Беккера манифестирует у более старших детей. Для девочек возраст проявления заболевания варьирует от 4 до 12 лет, у мальчиков чаще всего он составляет 18 лет.
Основой клинической картины миотонии Беккера является миотонический феномен. Он характеризуется наступающим после активного движения миотоническим спазмом с последующей замедленной релаксацией участвовавших в движении мышц; возникновением генерализованного миотонического спазма при попытке совершить быстрый двигательный акт; снижением спастичности при повторных движениях. Типично уменьшение проявленности миотонического синдрома при нахождении пациента в тепле и его увеличение на холоде.
К наиболее типичным и доступным к выявлению признакам миотонического феномена относятся: симптом кулака — невозможность быстро разжать пальцы после их сжатия в кулак, сгибание и приведение большого пальца кисти при ударе неврологическим молоточком по возвышению его тенора, появление характерного локального сокращения в форме валика при постукивании молоточком по мышце.
При болезни Беккера миотонический феномен более выражен, чем при болезни Томсена; у ряда пациентов он сопровождается болями в мышцах. Кроме поражения дистальных мышечных групп, может отмечаться миотония мышц проксимальных отделов конечностей. Характерно возникновение первых признаков болезни в мышцах ног. Затем, по прошествии нескольких лет, миотонический феномен появляется в мышцах рук. На поздних стадиях болезни Беккера в патологический процесс вовлекаются мимические мышцы. Может наблюдаться снижение мышечной силы. Типичные для миотонии Томсена мышечные гипертрофии встречаются довольно редко.
Диагностика миотонии Беккера
Выявление в ходе неврологического обследования проявлений миотонического феномена и отсутствие других патологических отклонений в статусе позволяет без затруднений диагностировать миотонию. Гораздо большую сложность представляет для невролога определение ее вида. Здесь важную роль играет анамнез заболевания (его дебют, порядок развития симптомов, особенности течения), семейный анамнез (наличие случаев миотонии Беккера у родственников), особенности клиники (например, отсутствие типичной для дистрофической миотонии мышечной гипотрофии).
Диагностический поиск обычно включает: биохимический анализ крови, электромиографию (ЭМГ) или электронейрографию (ЭНГ), биопсию мышц, консультацию генетика и проведение генетического анализа. В плане дифференциальной диагностики необходимо исключить миотонию Томсена, дистрофическую миотонию, миопатии, синдром регидного человека, псевдомиотонию при гипотиреозе.
Специфичных биохимических маркеров для миотонии Беккера не существует. У ряда пациентов в сыворотке крови наблюдается значительное повышение активности креатинфосфокиназы. Данные электромиографии позволяют выявить наличие патогномоничных для миотоний разрядов при сохранении параметров потенциалов ДЕ (двигательных единиц). Морфологическое исследование мышечных биоптатов обнаруживает гипертрофию волокон и централизацию их ядер, однако не является специфичным для миотонии Беккера. Подтверждением заболевания служат данные молекулярно-генетического анализа, свидетельствующие о наличие мутации в гене CLCN1.
Лечение миотонии Беккера
Как и большинство генных патологий заболевание не имеет радикального специфического лечения. Терапия направлена преимущественно на уменьшение явлений миотонического спазма. С этой целью рекомендовано применение дифенина, новокаинамида, карбамазепина, фенитоина и др. Для уменьшения отклонений в ионном равновесии пациентам назначаются диуретики (ацетазоламид) и препараты кальция, предписывается диета, ограничивающая поступление в организм солей калия. Из методов физиотерапии применяется электрофорез с кальцием. Важным элементом лечения является освоение пациентом специального комплекса ЛФК.
Больным миотонией Беккера следует избегать резких и быстрых движений, переохлаждений, пребывания в холоде. Это позволит им значительно уменьшить частоту миотонических приступов и облегчить течение болезни.
Прогноз и профилактика миотонии Беккера
Прогноз выздоровления неблагоприятный. При систематическом и комплексном лечении, исключении факторов, провоцирующих миотонические спазмы, возможно добиться более медленного прогрессирования болезни. Поскольку затруднения у пациентов вызывают лишь быстрые движения, большинство больных приспосабливаются к своему заболеванию, успешно проходят социальную и трудовую адаптацию, хотя и имеют ограниченную трудоспособность. Как правило, взрослые пациенты получают III группу инвалидности.
С профилактической целью семьям, в которых отмечались случаи миотонии Беккера, рекомендовано генетическое консультирование при планировании беременности, ведение беременности с проведением дородовой ДНК-диагностики.
Источник
Миопатия является врожденной патологией, вызванной генной мутацией. Механизм развития заболевания до конца не изучен, поэтому предсказать вероятность рождения больного ребенка не представляется возможным. Случается, что у двух абсолютно здоровых людей рождается ребенок с какой-либо формой миопатии. Установлено, что причиной является нарушение обмена в мышечных тканях, вследствие чего они теряют креатин и истощаются.
Миопатия Беккера, или доброкачественная псевдогипертрофическая миопатия, – наиболее легкая форма заболевания, которая впервые была описана в 1955 году Беккером и Кинером. Установлена генетическая общность миопатии Беккера и Дюшенна – обе разновидности вызывают аллельные мутации одних и тех же генов. Характерной особенностью дистрофии Беккера является то, что болеют только лица мужского пола, на 20 тыс. новорожденных приходится 1 заболевший ребенок.
Причины
Ген, который отвечает за кодирование дистрофина, мутирует, и происходит синтез аномально усеченного белка. Дистрофин продолжает вырабатываться, но в недостаточном количестве. Однако свои функции он частично выполняет, что и обусловливает доброкачественное течение болезни, в отличие от дистрофии Дюшенна, когда синтез белка полностью прекращается.
Белок дистрофин необходим организму для поддержания целостности мышечных волокон, их эластичности и устойчивости при сокращениях мышц. Усеченный белок не справляется с этой функцией в полном объеме, и целостность мембран мышечных волокон нарушается. Далее начинают происходить дегенеративные изменения цитоплазмы в мышцах, а в миоциты поступает слишком много ионов калия. Как результат – разрушение миофибрилл и мышечных волокон, которые замещает соединительная ткань. Этим и объясняется псевдогипертрофия – объем и плотность мышц увеличиваются, а их сократительная способность резко снижается.
Симптомы
Старт заболевания приходится на возраст от 5 до 15 лет, но может быть и гораздо позже, после 40 лет. Первые признаки – повышенная утомляемость и мышечная слабость в области таза и нижних конечностей. У некоторых пациентов отмечаются периодические и возникающие спонтанно судороги икроножных мышц. Трудно подниматься по лестнице, вставать и садиться, при попытке встать со стула приходится искать точку опоры. Может иметь место так называемый симптом Говерса, когда человек как бы переступает руками по поверхности ног, помогая таким образом телу выпрямиться.

Боль и судороги в мышцах ног – характерный признак миопатии
Всем наследственным миопатиям свойственно симметричное развитие мышечной атрофии. Сначала поражаются бедренные мышцы и тазовой области, позже процесс переходит к мускулатуре плеч и верхней части рук. На начальных стадиях формируется псевдогипертрофия в икроножных мышцах, позже к ним присоединяются дельтовидная, трех- и четырехглавая мышца (квадрицепс бедра). В дальнейшем псевдогипертрофия трансформируется в мышечную гипотрофию.
Симптомы миопатии Беккера выражаются:
- нарушением сердечного ритма – аритмией;
- болью в мышцах рук и ног, а также других частей тела;
- болевые ощущения в ногах усиливаются при ходьбе;
- походка приобретает новые черты и становится похожей на утиную;
- в мышцах ног чувствуются постоянные подергивания;
- нормально передвигаться и обходить препятствия становится все труднее;
- даже незначительная физическая нагрузка сопровождается одышкой и усталостью, а также опуханием ног.
Полный комплекс симптомов редко присутствует у одного больного, однако утомляемость и слабость в ногах ощущают абсолютно все пациенты.
Особенность миопатии Беккера в том, что прогрессирует она достаточно медленно, но в любом случае приводит к обездвиженности и скованности суставов. Процесс продолжается примерно до 40 лет, по достижении этого возраста двигательная активность обычно прекращается. Следует отметить, что скелетных деформаций, например, искривления позвоночника, не происходит. Мозговая деятельность остается нормальной, сердце и сосуды поражаются в слабой степени. В некоторых случаях возможно наступление импотенции и снижение полового влечения, иногда наблюдается гинекомастия и атрофия яичек.
Диагностика
Диагноз «прогрессирующая мышечная дистрофия» ставится на основании характерных симптомов – мышечной слабости и атрофии мускулатуры, а также наследственного анамнеза. Для подтверждения проводится биохимический анализ крови на КФК, выявляющий значительное превышение уровня креатинкиназы. Кроме этого, назначаются следующие клинические исследования:
- электромиография – для оценки функционального состояния скелетных мышц и периферических нервных окончаний. С помощью этого обследования определяется характер и тяжесть поражения мышечных тканей;
- рентгенография костей;
- биопсия мышечных волокон;
- электро- и эхокардиография.
Морфологическое исследование материала, взятого путем биопсии, позволяет определить неравномерность, некротические и дистрофические поражения мышц, а также установить процесс разрастания соединительных тканей. Кроме того, полученный биоптат окрашивается иммуноцитохимическим методом для выявления параметров дистрофина.
С помощью рентгенограммы трубчатых костей выявляются дистрофические изменения. В некоторых случаях установить точный диагноз можно только после проведения молекулярно-генетических тестов.

Одним из нарушений при дистрофии является утрата коленных рефлексов
Осмотр и лечение проводит врач-невролог, дифференциациальная диагностика осуществляется с миопатией Дрейфуса, Дюшена, Эрба-Рота и другими видами мышечных дистрофий. В случаях, когда мать является носителем дефектного гена, показана пренатальная диагностика. Если новорожденный мужского пола, вероятность наследования заболевания составляет 50%. Сделать необходимые анализы возможно, начиная с 11 недели беременности.
Лечение
Дистрофия Беккера является неизлечимым заболеванием, и пациенты получают преимущественно симптоматическую и метаболическую терапию. Однако ученые ведут активные поиски эффективных методов лечения, включая генные и клеточные. В настоящее время можно рассчитывать только на поддержание двигательной способности и самостоятельности пациента. Лечебные препараты, способные замедлить прогрессирование мышечной дистрофии:
- актопротекторы (Этилтеобензимидазол). Стимулируют физическую работоспособность и препятствуют утомлению;
- ингибиторы холинэстеразы (Неостигмин). Способствуют нервно-мышечной проводимости, повышают тонус гладких мышц;
- аденозинтрифосфорная кислота, или сокращенно АТФ. Применяется для улучшения трофики мышц внутримышечным введением 1-2 раза в день. Курс лечения – 30-40 инъекций, после месячного перерыва курс при необходимости повторяют;
- анаболические стероиды (Метиладростендиол). Использование лекарств этой группы помогает ускорить развитие и обновление клеток, тканей и мышц;
- сердечные препараты;
- витамины группы В и Е.
Медикаментозную терапию миопатии сочетают с физиотерапией, массажем и ЛФК. Комплекс мероприятий составляется с учетом посильной физической нагрузки на пациента, чтобы избежать чрезмерного перенапряжения ослабленной мускулатуры. В определенных случаях больные нуждаются в консультации ортопеда, который поможет подобрать специальные корректирующие устройства – корсеты, обувь и пр.

Мануальная терапия – один из способов коррекции состоянии пациента
Хирургическое вмешательство проводится в случаях, когда пациент испытывает слишком болезненные ощущения в сухожилиях мышц – операция способствует их удлинению путем коррекции контрактур.
Профилактика и прогноз
Наиболее информативным и действенным методом профилактики являются генетические тесты, которые необходимо проводить при планировании беременности. Такие исследования проводятся в женских консультациях, по их результатам оценивается степень риска появления патологии у новорожденного. Особенно это актуально для членов семей, в которых имели место случаи заболевания.
В семьях, где дети уже есть, обратиться к врачу рекомендуется в следующих случаях:
- если есть признаки отставания в развитии ребенка в возрасте до 1 года;
- мальчик быстро устает, и это не проходит с взрослением;
- ребенку становится трудно преодолевать лестничные марши, он часто падает и спотыкается;
- наблюдается нежелание играть в активные игры, прыгать, бегать.
Характерные признаки чаще всего проявляются в возрасте от 3-х до 5 лет, именно в это время их важно заметить и обратиться к врачу. Это поможет надолго отсрочить беспомощность и инвалидизацию.
Прогноз заболевания неблагоприятный, в конечном итоге пациенты погибают от дыхательной или сердечной недостаточности. Небольшой процент юношей уже к 20 годам нуждается в инвалидной коляске, однако 9 из 10 мужчин достаточно благополучно проходят 20-летний рубеж.
Улучшить качество жизни и продлить ее помогут лечебные мероприятия и занятия физическими упражнениями, а также использование ортопедических устройств. Несомненно, миопатия Беккера – серьезное заболевание, однако современная медицина не стоит на месте, и методы лечения постоянно совершенствуются. Применяя все доступные способы, можно добиться многого и увеличить период активности, бодрости и хорошего самочувствия.
Источник
